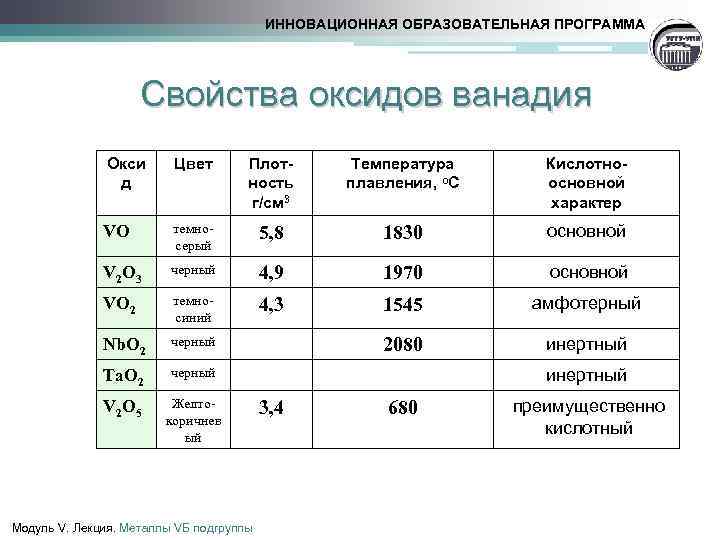
Карбиды вольфрама
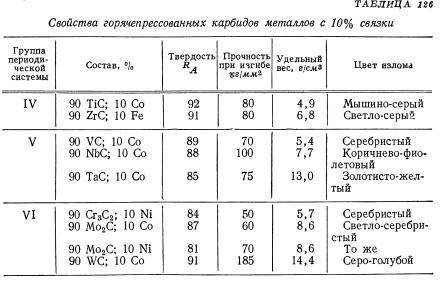
Твердые сплавы рассмотрим более подробно. Тугоплавкий металл может образовывать разные карбиды: полукарбид и монокарбид. Они отличаются способностью растворять в себе тугоплавкие металлы и взаимодействием с разными кислотами.
Вольфрам — металл имеющий разные карбиды
Также монокарбид уступает поликарбиду в устойчивости и твердости. А к преимуществам монокарбида можно отнести способность к образованию кристаллов в расплавленном вольфраме, что дает возможность использовать его в минералокерамических изделиях. Полукарбид обладает большей устойчивостью к температурам, легкостью внедрения в твердые растворы монокарбида с другими металлами (феррумом, кобальтом), повышенной износоустойчивостью.
Это интересно: Как правильно закалить нож в домашних условиях
Получение
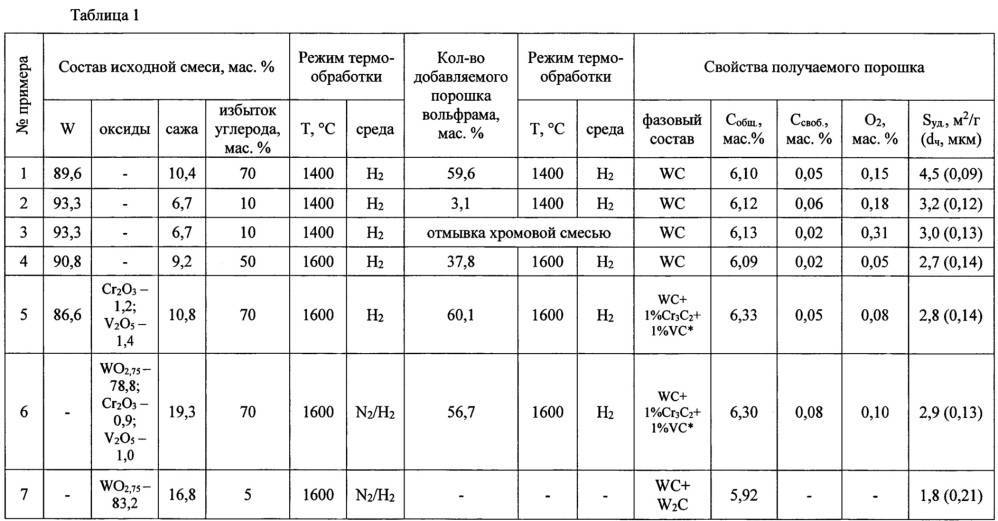
Карбид вольфрама можно получить одним из следующих способов.
Непосредственным насыщением вольфрама углеродом В основе процесса получения карбида вольфрама лежит реакция Образование WC происходит с образованием на поверхности частиц вольфрама монокарбида вольфрама, из которого внутрь частицы диффундирует углерод и образует ниже лежащий слой составом W2C. При получении WC используют порошок вольфрама, восстановленный из его оксида, и сажу. Взятые в необходимом количестве порошки смешивают, затем брикетируют или насыпают с утрамбовкой в графитовые контейнеры и помещают в печь. Для защиты порошка от окисления процесс синтеза ведут в среде водорода, который взаимодействуя с углеродом при температуре от 1300 °C образует ацетилен. Образование карбида вольфрама идёт в основном через газовую фазу за счёт углерода, содержащегося в газах. Реакции карбидизации имеют следующий вид: При наличии в среде окиси углерода процесс идёт по реакции Обычно процесс получения карбида вольфрама ведут при температуре 1300−1350 °C для мелкозернистых порошков вольфрама и 1600 °C для крупнозернистых, а время выдержки составляет от 1 до 2 часов. Полученные слегка спёкшиеся блоки карбида вольфрама измельчают и просеивают через сита. Восстановлением оксида вольфрама углеродом с последующей карбидизацией Этот метод в отличие от выше описанного совмещает процесс восстановления и карбидизации вольфрама, при этом в шихту добавляют недостающее количество сажи для образования карбида. Восстановление оксида вольфрама WO3 происходит через газовую фазу в среде CO и водорода. Восстановлением соединений вольфрама с последующей карбидизацией Ещё одним способом получения карбида вольфрама является нагрев смеси вольфрамовой кислоты, вольфрамового ангидрида (WO3) или паравольфрамата аммония ((NH4)10··xH2O) в среде водорода и метана при температуре 850−1000 °C. Осаждением из газовой фазы Получение карбида вольфрама из газовой фазы основано на разложении карбонила вольфрама при температуре 1000 °C. Электролизом расплавленных солей Электролиз смеси расплавленных бората натрия, карбоната натрия, фторида лития и вольфрамового ангидрида позволяет получить карбид вольфрама. Монокристаллы карбида вольфрама Монокристаллы WC могут быть получены выращиванием из расплава. Для этого смесь составом Co−40 %WC плавят в тигле из оксида алюминия при температуре 1600 °C и после гомогенизации расплава температуру снижают до 1500 °C со скоростью 1−3 °C/мин и выдерживают при этой температуре в течение 12 часов. После чего образец охлаждают и растворяют кобальтовую матрицу в кипящей соляной кислоте. Также может быть использован метод Чохральского для выращивания больших монокристаллов (до 1 см).
Это интересно: Вакуумная металлизация — технологический процесс, область применения, преимущества
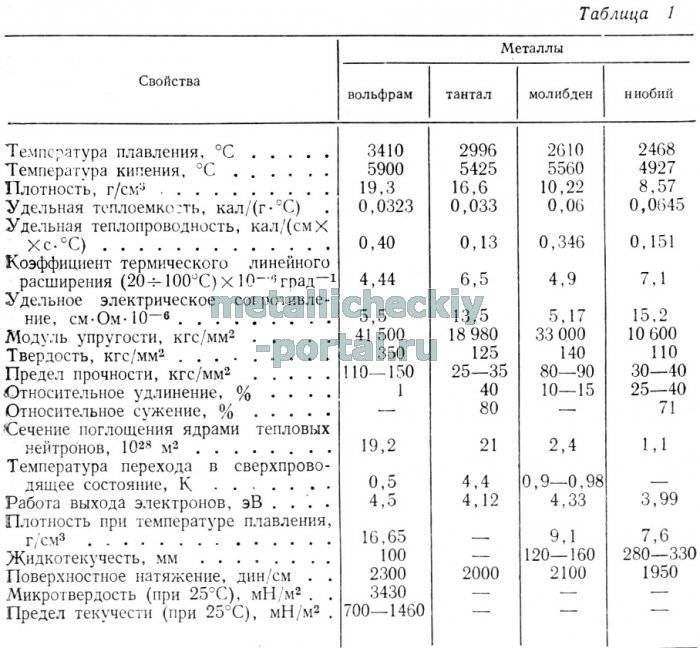
Свойства вольфрама (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Вольфрам |
| 102 | Прежнее название | |
| 103 | Латинское название | Wolframium |
| 104 | Английское название | Tungsten |
| 105 | Символ | W |
| 106 | Атомный номер (номер в таблице) | 74 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1781 г., Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. |
| 110 | Год открытия | 1783 г. |
| 111 | Внешний вид и пр. | Твёрдый, тугоплавкий, блестящий серебристо-серый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-вольфрам с кубической объёмно-центрированной кристаллической решёткой, – β-вольфрам с кубической кристаллической решёткой, именуемой фаза А15 |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000012 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O12 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 193 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 162 пм |
| 207 | Радиус иона (кристаллический) | W4+ 80 (6) пм, W5+ 76 (6) пм, W6+ 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 74 электрона, 74 протона, 110 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 758,76 кДж/моль (7,86403(10) эВ) |
| 305 | Электродный потенциал | W3+ + 3e– → W, Eo = +0,11 В, W6+ + 6e– → W, Eo = +0,68 В |
| 306 | Энергия сродства атома к электрону | 78,6 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 19,3 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 17,6 г/см3 (при температуре плавления 3422 °C и иных стандартных условиях, состояние вещества – жидкость) |
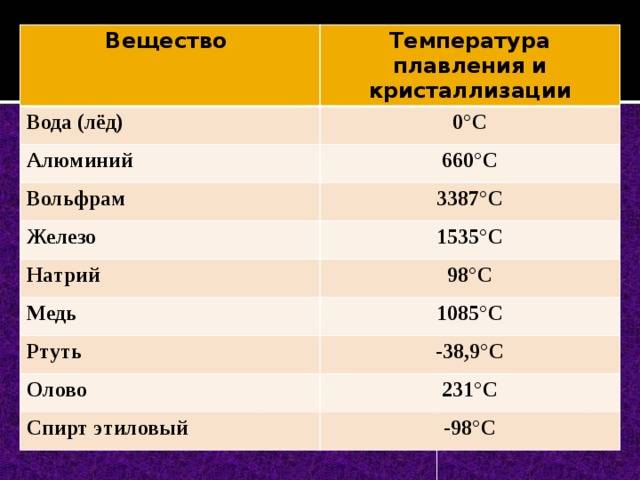
| 402 | Температура плавления* | 3422 °C (3695 K, 6192 °F) |
| 403 | Температура кипения* | 5930 °C (6203 K, 10706 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 52,31 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 774 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,114 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| 411 | Молярный объём | 9,53 см³/моль |
| 412 | Теплопроводность | 173 Вт/(м·К) (при стандартных условиях), 162,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-вольфрам |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,160 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 310 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-33-7 |
Примечание:
205* Эмпирический радиус вольфрама согласно и составляет 139 пм и 137 пм соответственно.
206* Ковалентный радиус вольфрама согласно и составляет 162±7 пм и 170 пм соответственно.
401* Плотность вольфрама согласно и составляет 19,25 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 19,32 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления вольфрама согласно составляет 3420 °C (3693,15 K, 6188 °F).
403* Температура кипения вольфрама согласно и составляет 5555 °C (5828 K, 10031 °F) и 5680 °C (5953,15 K, 10256 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) вольфрама согласно составляет 61,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) вольфрама согласно и составляет 824 кДж/моль и 769 кДж/моль соответственно.
Применение[ | ]
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам
Нить накаливания
- Тугоплавкость вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах или более эффективной при равном весе. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др. либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе.
Соединения вольфрама
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
- Некоторые соединения вольфрама применяются как катализаторы и пигменты.
- Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
- Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
Другие сферы применения
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Сплавы на основе вольфрама
Сплавы вольфрама возможно получить исключительно методом порошковой металлургии. Это вызвано большой разницей температур плавления входящих в состав сплава металлов. Порошки исходных составляющих после смешивания прессуются, а затем подвергаются спеканию. В результате капиллярных сил более легкоплавкие металлы заполняют пространство между зернами вольфрама, образуя монолитный сплав. На границах зерен образуются твердые растворы компонентов сплава.
Наибольшее распространение получили сплавы вольфрама с медью, железом и никелем. Самые распространенные сплавы ВНЖ и ВНМ включают в себя вольфрам — никель — железо и вольфрам — никель — медь.
Вольфрамовые сплавы находят применение для изготовления деталей и устройств, в которых важна высокая плотность при малых габаритных размерах. Это всевозможные противовесы, маховики, грузы центробежных регуляторов, сердечники пуль и снарядов.
Используемые в промышленности марки вольфрама обычно включают в себя некоторые добавки. Материал, легированный лантаном, обозначается как ВЛ, иттрием — ВИ. Указанные легирующие добавки еще более улучшают механические и технологические качества металла.
Легирование торием повышает эмиссионные свойства вольфрама, что особенно важно при изготовлении катодов мощных электровакуумных ламп. Данная добавка также улучшает способность к зажиганию электрической дуги при аргонно-дуговой сварке
Сплавы вольфрама с медью и серебром используются для изготовления контактов сильноточной коммутационной аппаратуры. Медь и серебро при высокой электропроводности не обладают высокой механической прочностью. При прохождении высоких токов возможно расплавление контактных групп. Контакты из вольфрамовых сплавов свободны от этих недостатков, не смотря на несколько большее электрическое сопротивление.
Высокая плотность сплавов позволят использовать их для изготовления контейнеров для хранения радиоактивных веществ, экранов для защиты от γ-излучения.
История открытия и изучения
Свое название металл получил от минерала вольфрамит. Его начали добывать в XVI веке. Тогда его называли «волчьей пеной». Вольфрам часто встречался в оловянных рудах, мешал выплавлять этот металл. Он переводил его в пену шлаков.
Первое научное упоминание о нахождении нового химического элемента появилось в 1781 году. Тогда знаменитый химик из Швеции Карл Шееле работал с минералом шеелит. Он обрабатывал его азотной кислотой, в ходе чего получил новый химический элемент с желтым оттенком. Он назвал его «тяжелым камнем». Через два года, братья Элюар получили из саксонского минерала новый металл.

Вольфрамит
Применение тугоплавкости вольфрама
Это качество металла широко используется для производства:
- нитей накаливания в приборах освещения;
- электродов в аргонно-дуговых сварках;
- элементов нагрева для высокотемпературных вакуумных печей сопротивления;
- электронно-лучевых трубок в мониторах, осциллографах, на радиолокационных станциях;
- электронных ламп.
Вакуумные лампы в большинстве отраслей заменены на полупроводники, кроме производства высоковольтного, мощного, высокочастотного оборудования, а также космической техники. Наряду с преимуществами, тугоплавкий металл имеет и недостатки:
- сложность механической обработки;
- при температуре воздуха, превышающей 400°С, образуются оксидные пленки, а при наличии в среде серосодержащих веществ — сульфидные пленки;
- требуются большие контактные давления для создания даже низкого сопротивления на участке электрического контакта.
Для нейтрализации описанных недостатков материал сплавляют с другими металлами, которые улучшают его свойство. Существует несколько таких соединений:
- Стеллит. В его состав, кроме вольфрама, входят кобальт и хром. Напылением или наплавлением он наносится на запчасти машин, инструментов, станков для увеличения износостойкости. Стеллит применяют для производства режущих инструментов.
- Быстрорежущие и инструментальные стали, из которых изготавливают сверла, фрезы, штампы. Кроме основных составляющих, указанные соединения могут содержать хром, марганец и кремний.
- Контактные сплавы. Легирующими металлами в них служат медь и серебро. Высокая электропроводимость этих материалов увеличивает данный показатель соединений, в которые они входят. Контактные сплавы вольфрама — материал, из которого производят выключатели, рубильники, электроды.
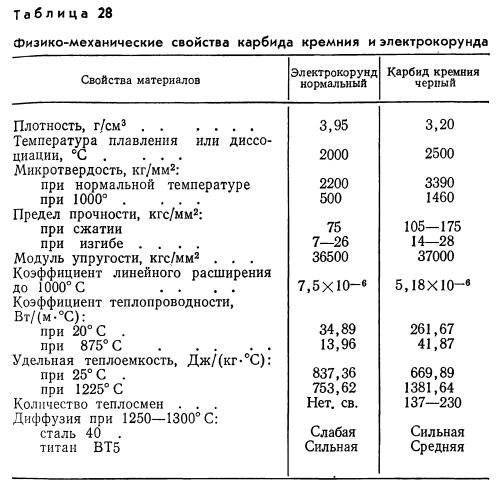
- Твердые сплавы. Их основой служит карбид вольфрама — соединение тугоплавкого металла с углеродом. Благодаря этим двум компонентам сплав отличается высокими твердостью и температурой плавления, износостойкостью. Перечисленные характеристики имеют значение для рабочих частей инструментов, используемых в бурении и резке. Массовая доля карбида вольфрама в твердом сплаве составляет 85–95%, оставшиеся проценты показывают содержание кобальта.
Свойства и марки вольфрама
Вольфрам имеет свои механические и физические свойства, а также несколько разновидностей марок.
К физическим свойствам относят:
- Коэффициент термического линейного расширения — 4,32*10 (-6) м/мК.
- Сопротивление электрическое — 5,5 мкОм*см.
- Теплопроводность — 129 Вт/(м*К).
- Теплоёмкость удельная — 0,147 Дж/(г*К).
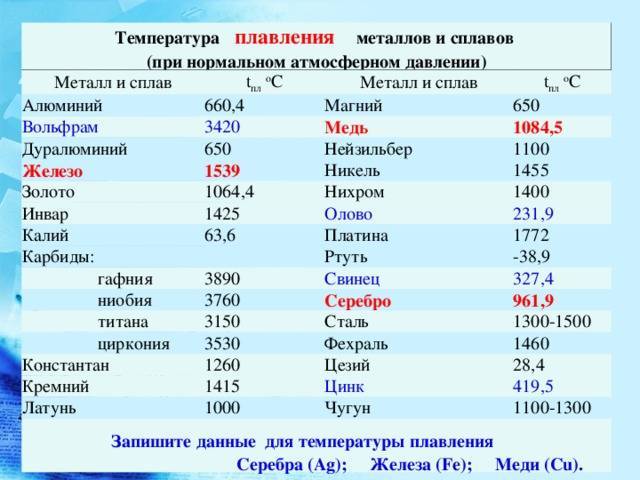
- Температура кипения — 5900 градусов.
- Температура плавления — 3380 градусов.
- Плотность — 19,3 г/см3.
- Атомный диаметр — 0,274 нм.
- Атомная масса — 183,84 г/моль.
- Атомный номер — 74.
Механические свойства:
- Относительное удлинение — 0%.
- Временное сопротивление — 800−1100 МПа.
- Коэффициент Пуассона 0,29.
- Модуль сдвига — 151,0 ГПа.
- Модуль упругости — 415,0 ГПа.
Отличается этот металл маленькой скоростью испарения даже при 2 тыс. градусов и очень большой точкой кипения — 5900 градусов. Свойствами, которые ограничивают область использования этого материала, являются малое сопротивление окислению, высокая склонность к ломкости и высокая плотность. На вид он напоминает сталь. Используется для того, чтобы изготавливать сплавы высокой прочности. Обработать его можно только после нагревания. Температура нагрева зависит от того, какой именно метод обработки вы собираетесь проводить.
Вольфрам имеет такие марки:
- МВ — сплав вольфрама и молибдена. Повышается прочность молибдена при сохранении пластичности после обжига.
- ВРН — вольфрам без присадки. В нём допустимо повышенное содержание примесей.
- ВР — сплав рения и вольфрама.
- ВЛ, ВИ, ВТ — вольфрам с присадкой окиси лантана, иттрия и тория соответственно. Повышают эмиссионные свойства вольфрама.
- ВМ — вольфрам с ториевой и кремнещелочной присадками. Повышает температуру рекристаллизации и прочность при высоких температурах.
- ВА — вольфрам с алюминиевой и кремнещелочной присадками. Увеличивает температуру первичной рекристаллизации, формоустойчивость при больших температурах, а также прочность после отжига.
- ВЧ — чистый без присадок.
СТРУКТУРА
 Кристалл вольфрама имеет объемноцентрированную кубическую решетку. Кристаллы вольфрама на холоду отличаются малой пластичностью, поэтому в процессе прессования порошка они практически почти не изменяют своей основной формы и размеров и уплотнение порошка происходит главным образом путем относительного перемещения частиц.
Кристалл вольфрама имеет объемноцентрированную кубическую решетку. Кристаллы вольфрама на холоду отличаются малой пластичностью, поэтому в процессе прессования порошка они практически почти не изменяют своей основной формы и размеров и уплотнение порошка происходит главным образом путем относительного перемещения частиц.
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
Химические свойства вольфрама:
- в природе состоит из стабильных изотопов (5 штук), массовые числа которых находятся в пределах 180-186;
- отделение 74 электронов атома W происходит легко;
- обладает 6 валентностью, в соединениях может иметь 0, 2, 3, 4 и 5-валентным;
- орбита элемента включает 2 яруса, что позволяет образовать крепкую химическую связь.
Наука относит вольфрам к химически активным элементам. Он может вступать в различные реакции и образовывать как простые, так и сложные соединения. В сплавах W чаще всего остается химически связанным. При этом с окислителями (например, с кислородом) он реагирует быстрее, чем другие металлы рода «тяжеловесов».
В случае нагревания элемента он еще быстрее вступает в реакцию с кислородом. Если в реакции участвуют водные пары, реакция протекает гораздо быстрее. Ученые выяснили: при нагреве элемента до 500 °C получается WO2 — низкий окислитель с высокой устойчивочтью. Он затягивает поверхность металла коричневой пленкой. Если повышать температуру — можно получить еще один окислитель, который называют промежуточным (W4O11). Он имеет синюю окраску, а если продолжить нагрев до температуры в 923°C, она изменится на лимонно-желтую. Этому будет способствовать WO3.
Если с вольфрамом смешивают сухой фтор, то даже при небольшом подогреве можно получить вещество WF6. Его именуют гексафторидом. Оно может плавиться даже при 2,5 градусах, а кипеть при 19,5. Такое же соединение можно получить и при использовании хлора. Однако для этой реакции потребуется высокая температура — около 600 °C.
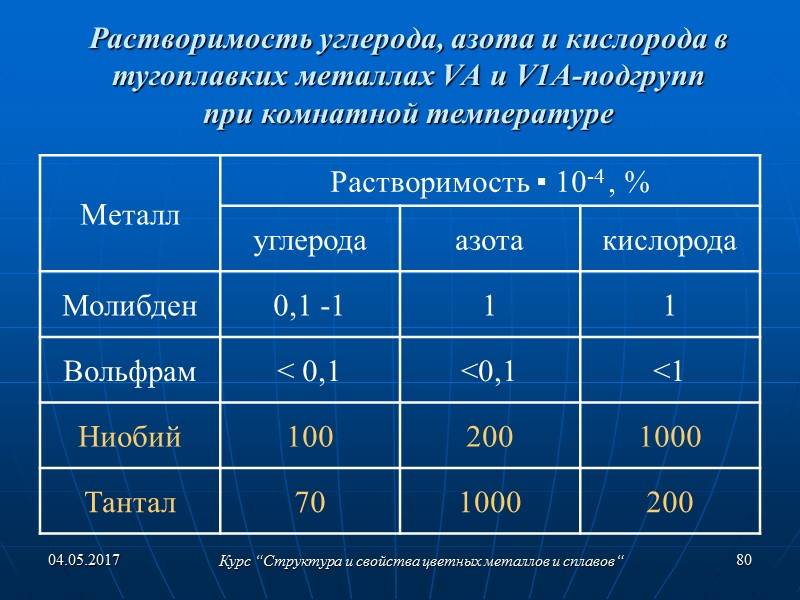
Также вольфрам легко вступает в реакции с йодом и бромом. С ними он образовывает такие малоустойчивые соединения как дибромид, ментамид, а также дииодид и тетрадид. При высоких температурах вольфрам соединяется с селеном, азотом, серой, а также с кремнием и углеродом.
Одним из интересных соединений считают карбонил. В этой реакции вольфрам реагирует на окись углерода. Именно здесь и проявляется его нулевая валентность. Однако это вещество сложно назвать устойчивым. Поэтому его можно получить только при создании специальных условий. Из карбонила получают плотные и ультратонкие покрытия чистого вольфрама.
Нужно уделить внимание и вольфрамовым соединениям. Некоторые из них поддаются полимеризации, в частности окись вольфрама
Свойства атома
- Имя, символ, номер — Вольфрам/Wolframium (W), 74
- Атомная масса (молярная масса), г/моль — 183,84 а. е. м.
- Электронная конфигурация — 4f14 5d4 6s2
- Радиус атома, пм — 141
Химические свойства
- Ковалентный радиус, пм — 170
- Радиус иона, пм — (+6e) 62 (+4e) 70
- Электроотрицательность, шкала Полинга — 2.3
- Электродный потенциал, В — W < W3+ 0,11
- W < W6+ 0,68
- Степени окисления — 6, 5, 4, 3, 2, 0
- Энергия ионизации, кДж/моль(1-й ионизац. потенциал, эВ) — 769,7 (7,98)
Термодинамические свойства простого вещества
- Плотность, кг/м3 (при н. у., г/см3) — 19300 (19,3)
- Температура плавления, °C, K — 3422, 3695
- Температура кипения, °C, K — 5555, 5828
- Теплота плавления, кДж/кг, кДж/моль — 191, 35
- Теплота испарения, кДж/кг, кДж/моль — 4482, 824
- Теплоемкость, кДж/(кг·°С) — 0,134
- Молярная теплоемкость, Дж/(K·моль) — 24,27
- Молярный объем, см3/моль — 9,53
Прочие характеристики
- Теплопроводность, K, Вт/(м·К) — 300, 173
- Удельное электросопротивление при 20°С, ом·мм2/м — 5,03
- Коэффициент теплопроводности при 20°С, кал/ (см·сек·град) — 0,4
- Коэффициент линейного расширения, 1/град — 43·10-6
- Временное сопротивление при растяжении, кг/мм2 — 35
Тяжелые сплавы вольфрама

Все сплавы на основе вольфрама, которые обладают высоким показателем плотности, называют тяжелыми. Их получают только при помощи методов порошковой металлургии. Вольфрам всегда является основой тяжелых сплавов, где его содержание может составлять до 98 %. Кроме этого металла, в тяжелые сплавы добавляется никель, медь и железо. Однако в них могут входить и хром, серебро, кобальт, молибден. Самую большую популярность получили сплавы ВМЖ (вольфрам – никель – железо) и ВНМ (вольфрам – никель – медь). Высокий уровень плотности таких сплавов позволяет им поглощать опасное гамма-излучение. Из них изготавливают маховики колес, электрические контакты, роторы для гироскопов.
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
Свойства
Вольфрам — это металл светло-серого цвета с характерным блеском, напоминает платину. Особенность данного элемента заключается в тугоплавкости. Стоит отметить ряд и иных важных свойств.
Физические
Так, металл отличается самой высокой температурой плавления в 3420 °C и кипения в 5555 °C. Также для него характерно следующее:
- плотность вольфрама без примесей составляет 19,25 г/см³;
- имеет повышенную устойчивость к изменениям в вакууме;
- оценка твердости по Бринеллю выражается значением 488 кг/мм²;
- высокая тепло- и электропроводность;
- парамагнетик;
- поддается ковке при температуре в 1,6 тысячи градусов по Цельсию.
Металл по достоинству признается как один из самых тяжелых и твердых.
Оптические
Что касается оптической характеристики, то вольфрам по принятому типу считается изотропным. При рассмотрении по плеохроизму — не плеохроирует. Также он не является флюоресцентным.
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
|
|
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
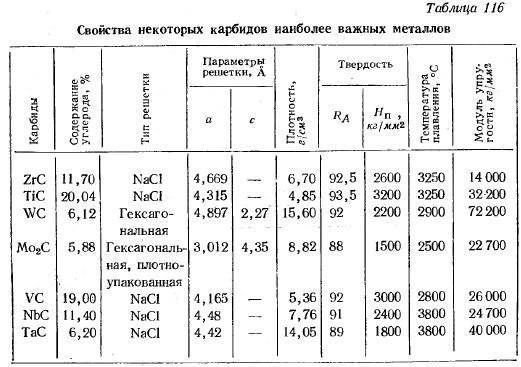
Получение карбидов
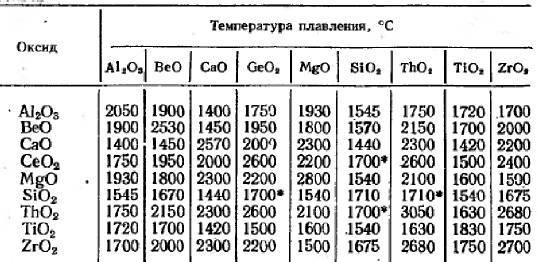
Первые два вида карбидов, которые мы рассмотрели, а именно ковалентные и солеобразные, получают чаще всего одним простым способом: реакцией оксида элемента и кокса при высокой температуре. При этом часть кокса, состоящего из углерода, соединяется с атомом элемента в составе оксида, и образует карбид. Другая часть «забирает» кислород и образует угарный газ. Такой способ очень энергозатратен, так как требует поддержания высокой температуры (порядка 1600-2500 градусов) в зоне реакции.
Для получения некоторых видов соединений используют альтернативные реакции. Например, разложение соединения, которое в конечном итоге даёт карбид. Формула реакции зависит от конкретного соединения, поэтому обсуждать её мы не будем.
Прежде чем завершить нашу статью, обсудим несколько интересных карбидов и поговорим о них подробнее.